Termodinamika fizikanın mühüm sahəsidir. Əminliklə deyə bilərik ki, onun nailiyyətləri texnoloji eranın yaranmasına səbəb olub və son 300 il ərzində bəşəriyyət tarixinin gedişatını böyük ölçüdə müəyyən edib. Məqalədə termodinamikanın birinci, ikinci və üçüncü qanunları və onların praktikada tətbiqi müzakirə olunur.
Termodinamika nədir?
Termodinamikanın qanunlarını tərtib etməzdən əvvəl gəlin fizikanın bu bölməsinin nə etdiyini anlayaq.
"Termodinamik" sözü yunan mənşəlidir və "istilik səbəbindən hərəkət" deməkdir. Yəni fizikanın bu sahəsi istənilən proseslərin tədqiqi ilə məşğul olur, bunun nəticəsində istilik enerjisi mexaniki hərəkətə və əksinə çevrilir.
Termodinamikanın əsas qanunları 19-cu əsrin ortalarında tərtib edilmişdir. "Hərəkət və istilik" elmi bütün sistemin davranışını bütövlükdə nəzərdən keçirir, onun makroskopik parametrlərinin - temperaturun, təzyiqin və həcmin dəyişməsini öyrənir və mikroskopik quruluşuna diqqət yetirmir. Üstəlik, onlardan birincisi qanunların formalaşmasında fundamental rol oynayırfizikada termodinamika. Maraqlıdır ki, onlar yalnız eksperimental müşahidələrdən əldə edilir.
Termodinamik sistem anlayışı

Bu, bütöv hesab edilən hər hansı atomlar, molekullar və ya digər elementlər qrupu deməkdir. Hər üç qanun termodinamik sistem adlanan sistem üçün tərtib edilmişdir. Nümunələr: Yer atmosferi, hər hansı canlı orqanizm, daxili yanma mühərrikindəki qaz qarışığı və s.
Termodinamikada bütün sistemlər üç növdən birinə aiddir:
- Açıq. Onlar ətraf mühitlə həm istilik, həm də maddə mübadiləsi aparırlar. Məsələn, yemək bir qazanda açıq odda bişirilirsə, bu açıq sistemin bariz nümunəsidir, çünki qazan xarici mühitdən (oddan) enerji alır, özü isə istilik şəklində enerji yayır, və ondan su da buxarlanır (maddələr mübadiləsi).
- Bağlanır. Belə sistemlərdə enerji mübadiləsi baş versə də, ətraf mühitlə maddə mübadiləsi olmur. Əvvəlki vəziyyətə qayıdaq: çaydanı qapaq ilə bağlasanız, qapalı sistem əldə edə bilərsiniz.
- İzolyasiya. Bu, ətrafdakı kosmosla maddə və ya enerji mübadiləsi aparmayan bir növ termodinamik sistemdir. Məsələn, tərkibində isti çay olan termos ola bilər.
Termodinamik temperatur

Bu anlayış ətrafdakı cisimləri əmələ gətirən hissəciklərin sürətini əks etdirən kinetik enerjisi deməkdir.hissəciklərin təsadüfi hərəkəti. Nə qədər böyükdürsə, temperatur bir o qədər yüksəkdir. Müvafiq olaraq, sistemin kinetik enerjisini azaldaraq, biz onu soyuruq.
Bu anlayış ətraf cisimləri əmələ gətirən zərrəciklərin kinetik enerjisini ifadə edir ki, bu da hissəciklərin xaotik hərəkətinin sürətini əks etdirir. Nə qədər böyükdürsə, temperatur bir o qədər yüksəkdir. Müvafiq olaraq, sistemin kinetik enerjisini azaldaraq, biz onu soyuruq.
Termodinamik temperatur Kelvin ilə SI (Beynəlxalq Vahidlər Sistemi) ilə ifadə olunur (bu şkalayı ilk dəfə təklif edən ingilis alimi Uilyam Kelvinin şərəfinə). Termodinamikanın birinci, ikinci və üçüncü qanunlarını anlamaq temperaturun tərifi olmadan mümkün deyil.
Kelvin şkalası üzrə bir dərəcə bölgüsü də bir dərəcə Selsiyə uyğun gəlir. Bu vahidlər arasında çevirmə aşağıdakı düstura uyğun olaraq həyata keçirilir: TK =TC + 273, 15, burada TK və TC - müvafiq olaraq Kelvin və Selsi dərəcələrində temperatur.
Kelvin şkalasının özəlliyi ondadır ki, onun mənfi dəyərləri yoxdur. İçindəki sıfır (TC=-273, 15 oC) sistemin hissəciklərinin istilik hərəkəti tamamilə olmadıqda vəziyyətə uyğundur., onlar "donmuş" görünür.
Enerjinin saxlanması və termodinamikanın 1-ci qanunu

1824-cü ildə fransız mühəndis və fizik Nikolas Léonard Sadi Karno nəinki fizikanın inkişafına səbəb olan cəsarətli bir təkliflə çıxış etdi, həm də texnologiyanın təkmilləşməsində böyük addım oldu. Onunaşağıdakı kimi ifadə oluna bilər: "Enerji yaradıla və ya məhv edilə bilməz, o, yalnız bir vəziyyətdən digərinə ötürülə bilər."
Əslində Sadi Karnotun ifadəsi termodinamikanın 1-ci qanununun əsasını təşkil edən enerjinin saxlanması qanununu irəli sürür: “Sistem xaricdən enerji alanda onu başqa formalara çevirir, əsas termal və mexaniki."
1-ci qanunun riyazi düsturu aşağıdakı kimi yazılır:
Q=ΔU + A, burada Q ətraf mühitin sistemə ötürdüyü istilik miqdarı, ΔU bu sistemin daxili enerjisindəki dəyişiklik, A mükəmməl mexaniki işdir.
Adiabatik proseslər
Onlara yaxşı misal olaraq hava kütlələrinin dağ yamacları boyunca hərəkətini göstərmək olar. Belə kütlələr nəhəngdir (kilometr və ya daha çox) və hava əla istilik izolyatorudur. Qeyd olunan xüsusiyyətlər qısa müddət ərzində hava kütlələri ilə baş verən istənilən prosesləri adiabatik hesab etməyə imkan verir. Hava dağ yamacına qalxdıqda onun təzyiqi aşağı düşür, genişlənir, yəni mexaniki işlər görür və nəticədə soyuyur. Əksinə, hava kütləsinin aşağıya doğru hərəkəti onun içindəki təzyiqin artması ilə müşayiət olunur, sıxılır və buna görə də çox isti olur.
Əvvəlki yarımbaşlıqda müzakirə edilən termodinamika qanununun tətbiqi adiabatik proses nümunəsi ilə ən asan şəkildə nümayiş etdirilir.
Tərifə görə, bunun nəticəsində ilə enerji mübadiləsi olmur.mühit, yəni yuxarıdakı tənlikdə Q=0. Bu, aşağıdakı ifadəyə gətirib çıxarır: ΔU=-A. Buradakı mənfi işarəsi sistemin öz daxili enerjisini az altmaqla mexaniki işi yerinə yetirməsi deməkdir. Yadda saxlamaq lazımdır ki, daxili enerji birbaşa sistemin temperaturundan asılıdır.
İstilik proseslərin istiqaməti
Bu məsələ termodinamikanın 2-ci qanunundan bəhs edir. Şübhəsiz ki, hər kəs fərq etdi ki, fərqli temperaturlu iki obyekti təmasda tutsanız, soyuq həmişə istiləşəcək, isti isə soyuyacaq. Nəzərə alın ki, tərs proses termodinamikanın birinci qanunu çərçivəsində baş verə bilər, lakin praktikada heç vaxt həyata keçirilmir.
Bu prosesin (və Kainatdakı bütün məlum proseslərin) dönməzliyinin səbəbi sistemin daha çox ehtimal olunan vəziyyətə keçməsidir. Fərqli temperaturlu iki cismin təması ilə nəzərdən keçirilən nümunədə sistemin bütün hissəciklərinin eyni kinetik enerjiyə malik olacağı ən çox ehtimal olunan vəziyyət olacaqdır.
Termodinamikanın ikinci qanununu belə ifadə etmək olar: "İstilik heç vaxt özbaşına soyuq cisimdən istiyə ötürülə bilməz". Əgər entropiya anlayışını nizamsızlıq ölçüsü kimi təqdim etsək, o zaman onu aşağıdakı kimi təqdim etmək olar: “İstənilən termodinamik proses entropiyanın artması ilə gedir”.
İstilik mühərriki

Bu termin ona xarici enerjinin verilməsi hesabına mexaniki işləri yerinə yetirə bilən sistem kimi başa düşülür. Birinciistilik maşınları buxar maşınları idi və 17-ci əsrin sonunda icad edilmişdir.
Termodinamikanın ikinci qanunu onların effektivliyinin müəyyən edilməsində həlledici rol oynayır. Sadi Carnot həmçinin müəyyən etdi ki, bu cihazın maksimum səmərəliliyi: Effektivlik=(T2 - T1)/T2, burada T2 və T1 qızdırıcı və soyuducu temperaturlarıdır. Mexanik iş yalnız isti bədəndən soyuq bədənə istilik axını olduqda həyata keçirilə bilər və bu axını 100% faydalı enerjiyə çevirmək mümkün deyil.
Aşağıdakı şəkildə istilik mühərrikinin işləmə prinsipi göstərilir (Qabs - maşına ötürülən istilik, Qced - istilik itkisi, W - faydalı iş, P və V - pistonda təzyiq və qazın həcmi).
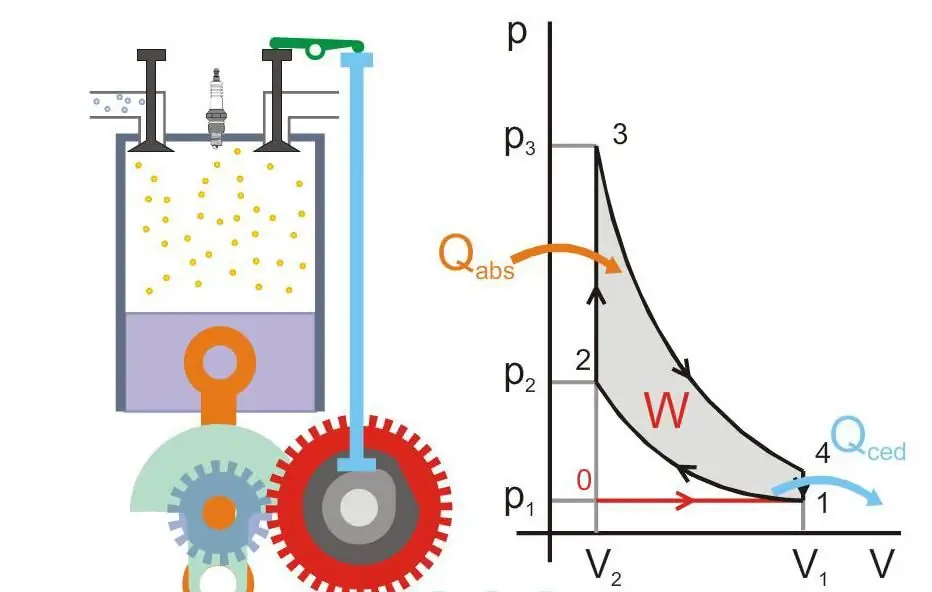
Mütləq sıfır və Nernst postulatı
Nəhayət, termodinamikanın üçüncü qanununun nəzərdən keçirilməsinə keçək. Onu Nernst postulatı da adlandırırlar (onu ilk dəfə 20-ci əsrin əvvəllərində formalaşdıran alman fizikinin adı). Qanunda deyilir: “Mütləq sıfıra sonlu sayda proseslərlə nail olmaq olmaz”. Yəni bir maddənin molekullarını və atomlarını tamamilə "dondurmaq" heç bir şəkildə mümkün deyil. Bunun səbəbi ətraf mühitlə daimi mövcud istilik mübadiləsidir.

Termodinamikanın üçüncü qanunundan çıxarılan faydalı bir nəticə ondan ibarətdir ki, mütləq sıfıra doğru hərəkət etdikcə entropiya azalır. Bu o deməkdir ki, sistem özünü təşkil etməyə meyllidir. Bu fakt ola bilərməsələn, soyuduqda paramaqnitləri ferromaqnit vəziyyətinə köçürmək üçün istifadə edin.
Qeyd etmək maraqlıdır ki, indiyədək əldə edilmiş ən aşağı temperatur 5·10−10 K (2003, MIT laboratoriyası, ABŞ).






