Termodinamikanın mühüm bölməsi maddənin müxtəlif fazaları arasında çevrilmələrin öyrənilməsidir, çünki bu proseslər praktikada baş verir və müəyyən şərtlər altında sistemin davranışını proqnozlaşdırmaq üçün fundamental əhəmiyyət kəsb edir. Bu çevrilmələr məqalənin həsr olunduğu faza keçidləri adlanır.
Faza və sistem komponenti anlayışı

Fizikada faza keçidlərinin nəzərdən keçirilməsinə keçməzdən əvvəl fazanın özünün anlayışını müəyyən etmək lazımdır. Ümumi fizika kursundan məlum olduğu kimi, maddənin üç vəziyyəti var: qaz, bərk və maye. Elmin xüsusi bölməsində - termodinamikada qanunlar maddənin birləşmə halları üçün deyil, fazaları üçün tərtib edilir. Faza homojen bir quruluşa malik olan, xüsusi fiziki və kimyəvi xassələri ilə xarakterizə olunan və interfaza adlanan sərhədlərlə maddənin qalan hissəsindən ayrılan müəyyən həcmli maddə kimi başa düşülür.
Beləliklə, "faza" anlayışı xassələr haqqında daha praktiki əhəmiyyətli məlumat daşıyırmateriya onun birləşmə vəziyyətindən daha çox. Məsələn, dəmir kimi bir metalın bərk vəziyyəti aşağıdakı fazalarda ola bilər: aşağı temperaturlu maqnit bədən mərkəzli kub (BCC), aşağı temperaturlu qeyri-maqnit bcc, üz mərkəzli kub (fcc) və yüksək- temperatur qeyri-maqnit bcc.
Termodinamikanın qanunlarında "faza" anlayışı ilə yanaşı, müəyyən bir sistemi təşkil edən kimyəvi elementlərin sayını ifadə edən "komponentlər" terminindən də istifadə olunur. Bu o deməkdir ki, faza ya monokomponent (1 kimyəvi element) və ya çoxkomponentli (bir neçə kimyəvi element) ola bilər.
Gibbs teoremi və sistemin fazaları arasında tarazlıq

Faza keçidlərini başa düşmək üçün onlar arasındakı tarazlıq şərtlərini bilmək lazımdır. Bu şərtləri onların hər biri üçün Gibbs tənlikləri sistemini həll etməklə, xarici təsirdən təcrid olunmuş sistemin ümumi Gibbs enerjisi dəyişməyi dayandırdıqda tarazlıq vəziyyətinə çatdığını nəzərə alaraq riyazi olaraq əldə etmək olar.
Göstərilən tənliklər sisteminin həlli nəticəsində bir neçə faza arasında tarazlığın mövcudluğu üçün şərtlər əldə edilir: təcrid olunmuş sistem yalnız bütün fazalarda təzyiqlər, kimyəvi potensiallar və temperaturlar olduqda təkamülünü dayandıracaq. bir-birinə bərabərdir.
Tarazlıq üçün Gibbs faza qaydası

Bir neçə faza və komponentdən ibarət sistem nəinki tarazlıqda ola bilərmüəyyən şərtlərdə, məsələn, müəyyən bir temperaturda və təzyiqdə. Tarazlıq üçün Gibbs teoremindəki bəzi dəyişənlər həm fazaların sayını, həm də bu tarazlıqda olan komponentlərin sayını saxlamaqla dəyişdirilə bilər. Sistemdəki tarazlığı pozmadan dəyişdirilə bilən dəyişənlərin sayı bu sistemin azadlıqlarının sayı adlanır.
F fazadan və k komponentdən ibarət sistemin l sərbəstliklərinin sayı unikal olaraq Gibbs faza qaydasından müəyyən edilir. Bu qayda riyazi olaraq aşağıdakı kimi yazılır: l + f=k + 2. Bu qayda ilə necə işləmək olar? Çox sadə. Məsələn, sistemin f=3 tarazlıq fazasından ibarət olduğu məlumdur. Belə bir sistemdə minimum neçə komponent ola bilər? Sualı aşağıdakı kimi əsaslandıraraq cavab verə bilərsiniz: tarazlıq vəziyyətində ən sərt şərtlər yalnız müəyyən göstəricilərdə həyata keçirildikdə mövcuddur, yəni hər hansı bir termodinamik parametrin dəyişməsi balanssızlığa səbəb olacaqdır. Bu o deməkdir ki, azadlıqların sayı l=0. l və f-nin məlum qiymətlərini əvəz edərək k=1 alırıq, yəni üç fazanın tarazlıqda olduğu sistem bir komponentdən ibarət ola bilər. Bunun bariz nümunəsi suyun üçqat nöqtəsidir, burada buz, maye su və buxar müəyyən temperatur və təzyiqlərdə tarazlıqda mövcuddur.
Faza çevrilmələrinin təsnifatı
Tarazlıqda olan sistemdə bəzi termodinamik parametrləri dəyişməyə başlasanız, bir fazanın necə yox olacağını, digərinin isə necə görünəcəyini müşahidə edə bilərsiniz. Bu prosesin sadə nümunəsi buzun qızdırıldığı zaman əriməsidir.
Gibbs tənliyinin yalnız iki dəyişəndən (təzyiq və temperatur) asılı olduğunu və faza keçidinin bu dəyişənlərdə dəyişikliyi nəzərdə tutduğunu nəzərə alsaq, riyazi olaraq fazalar arasında keçid Gibbs enerjisini onun enerjisinə görə diferensiallaşdırmaqla təsvir edilə bilər. dəyişənlər. Məhz bu yanaşma 1933-cü ildə avstriyalı fizik Paul Ehrenfest tərəfindən faza tarazlığının dəyişməsi ilə baş verən bütün məlum termodinamik proseslərin təsnifatını tərtib edərkən istifadə edilmişdir.
Termodinamikanın əsaslarından belə nəticə çıxır ki, Gibbs enerjisinin temperatura görə birinci törəməsi sistemin entropiyasının dəyişməsinə bərabərdir. Gibbs enerjisinin təzyiqə görə törəməsi həcm dəyişikliyinə bərabərdir. Əgər sistemdəki fazalar dəyişdikdə, entropiya və ya həcm pozulursa, yəni qəfil dəyişirsə, o zaman birinci dərəcəli faza keçidindən danışırlar.
Bundan başqa, Gibbs enerjisinin temperatur və təzyiqə görə ikinci törəmələri müvafiq olaraq istilik tutumu və həcmli genişlənmə əmsalıdır. Fazalar arasında transformasiya göstərilən fiziki kəmiyyətlərin dəyərlərində fasilə ilə müşayiət olunursa, ikinci dərəcəli faza keçidindən danışılır.
Fazalar arasında çevrilmə nümunələri

Təbiətdə çoxlu sayda müxtəlif keçidlər var. Bu təsnifat çərçivəsində birinci növ keçidlərin parlaq nümunələri sistemdə həcm artımı olduqda metalların əriməsi və ya havadan su buxarının kondensasiyası prosesləridir.
İkinci dərəcəli keçidlərdən danışsaq, o zaman parlaq nümunələr dəmirin temperaturda maqnit vəziyyətindən paramaqnit vəziyyətinə çevrilməsidir.768 ºC və ya mütləq sıfıra yaxın temperaturlarda metal keçiricinin superkeçirici vəziyyətə çevrilməsi.
Birinci növ keçidləri təsvir edən tənliklər
Praktikada çox vaxt sistemdə faza çevrilmələri baş verdikdə temperaturun, təzyiqin və udulmuş (buraxılan) enerjinin necə dəyişdiyini bilmək lazımdır. Bu məqsədlə iki mühüm tənlik istifadə olunur. Onlar termodinamikanın əsaslarına dair biliklərə əsaslanaraq əldə edilir:
- Müxtəlif fazalar arasında transformasiyalar zamanı təzyiq və temperatur arasında əlaqə quran Klapeyron düsturu.
- Transformasiya zamanı udulmuş (buraxılan) enerjini və sistemin temperaturunu birləşdirən Klauzius düsturu.
Hər iki tənliyin istifadəsi təkcə fiziki kəmiyyətlərin kəmiyyət asılılıqlarının əldə edilməsində deyil, həm də faza diaqramlarında tarazlıq əyrilərinin yamacının işarəsinin müəyyən edilməsindədir.
İkinci növ keçidləri təsvir etmək üçün tənlik

1-ci və 2-ci növ faza keçidləri müxtəlif tənliklərlə təsvir olunur, çünki ikinci dərəcəli keçidlər üçün Klauzius və Klauzius tənliklərinin tətbiqi riyazi qeyri-müəyyənliyə gətirib çıxarır.
Sonuncunu təsvir etmək üçün Ehrenfest tənliklərindən istifadə olunur ki, onlar çevrilmə prosesi zamanı istilik tutumunun dəyişməsi və həcmli genişlənmə əmsalını bilməklə təzyiq və temperaturun dəyişməsi arasında əlaqə yaradır. Ehrenfest tənlikləri maqnit sahəsinin olmadığı zaman keçirici-superkeçirici keçidlərini təsvir etmək üçün istifadə olunur.
Əhəmiyyətfaza diaqramları
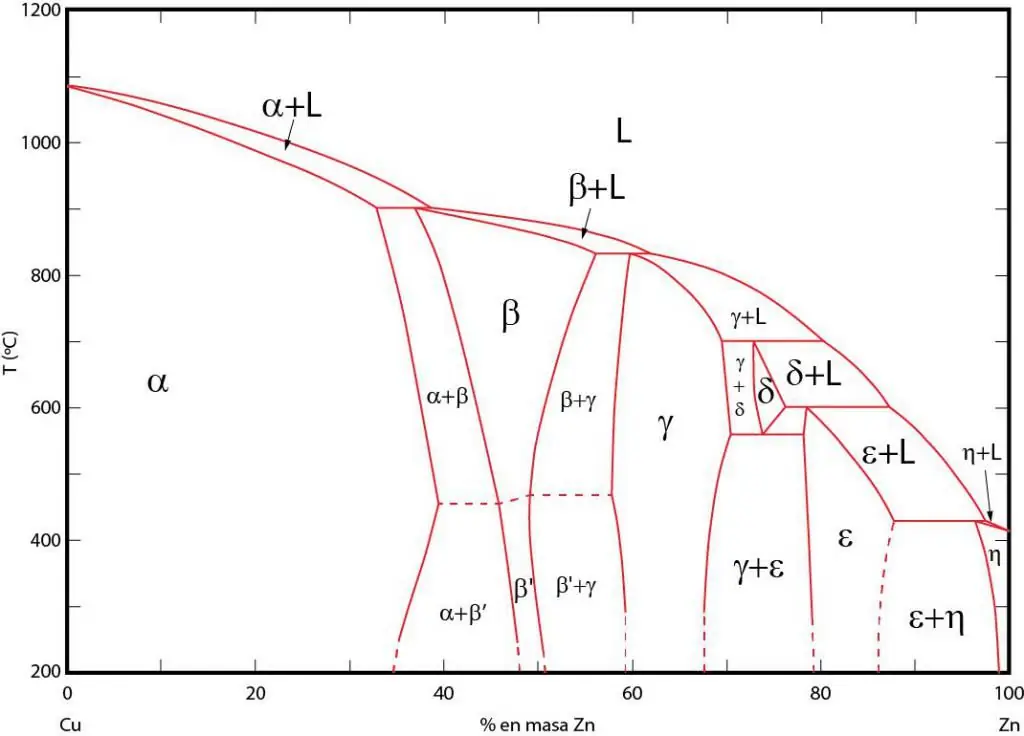
Faza diaqramları müvafiq fazaların tarazlıqda mövcud olduğu sahələrin qrafik təsviridir. Bu sahələr fazalar arasında tarazlıq xətləri ilə ayrılır. Tez-tez P-T (təzyiq-temperatur), T-V (temperatur-həcmi) və P-V (təzyiq-həcmi) faza diaqramlarından istifadə olunur.
Faza diaqramlarının əhəmiyyəti ondan ibarətdir ki, onlar xarici şərtlər müvafiq olaraq dəyişdikdə sistemin hansı mərhələdə olacağını proqnozlaşdırmağa imkan verir. Bu məlumat istənilən xassələrə malik struktur əldə etmək üçün müxtəlif materialların istilik müalicəsində istifadə olunur.






