Dövrümüzdə fizika çox geniş yayılmış bir elmə çevrilmişdir. Sözün əsl mənasında hər yerdə mövcuddur. Ən elementar misal: həyətinizdə alma ağacı böyüyür, meyvələr onun üzərində yetişir, vaxt gəlir və almalar düşməyə başlayır, bəs onlar hansı istiqamətə düşürlər? Ümumdünya cazibə qanunu sayəsində dölümüz yerə düşür, yəni aşağı düşür, amma yuxarı deyil. Bu, fizikanın ən məşhur nümunələrindən biri idi, lakin gəlin termodinamikaya, daha dəqiq desək, həyatımızda heç də az əhəmiyyət kəsb etməyən faza tarazlığına diqqət yetirək.
Termodinamika

İlk öncə bu terminə nəzər salaq. ΘερΜοδυναΜική - söz yunan dilində belə görünür. Birinci hissə ΘερΜo "istilik", ikinci δυναΜική isə "güc" deməkdir. Termodinamika fizikanın makroskopik sistemin xassələrini, həmçinin enerjinin çevrilməsi və ötürülməsinin müxtəlif üsullarını öyrənən bir sahəsidir. Bu bölmədə müxtəlif vəziyyətlər və proseslər xüsusi olaraq öyrənilir ki, temperatur anlayışı təsvirə daxil edilsin (bu, termodinamik sistemi xarakterizə edən fiziki kəmiyyətdir və istifadə edərək ölçülür.müəyyən məişət texnikası). Termodinamik sistemlərdə gedən bütün proseslər yalnız mikroskopik kəmiyyətlərlə (təzyiq və temperatur, həmçinin komponentlərin konsentrasiyası) təsvir olunur.
Clapeyron-Clausius tənliyi
Hər bir fizik bu tənliyi bilir, amma gəlin onu hissə-hissə parçalayaq. Bu, müəyyən maddənin bir fazadan digərinə keçidinin tarazlıq proseslərinə aiddir. Bu, belə nümunələrdə aydın görünür: ərimə, buxarlanma, sublimasiya (nəmi tamamilə aradan qaldırmaqla baş verən məhsulların qorunması yollarından biri). Düstur davam edən prosesləri aydın şəkildə göstərir:
- n=PV/RT;
- burada T maddənin temperaturudur;
- P-təzyiq;
- R-xüsusi faza keçid istiliyi;
- V-xüsusi həcmdə dəyişiklik.
Tənliyin yaranma tarixi

Klauzius-Klapeyron tənliyi termodinamikanın ikinci qanununun əla riyazi izahıdır. “Klauzius bərabərsizliyi” də adlandırılır. Təbii ki, teorem sistemdəki istilik axını ilə entropiya, eləcə də onun mühiti arasındakı əlaqəni izah etmək istəyən alimin özü tərəfindən hazırlanmışdır. Bu tənlik Klauzius tərəfindən entropiyanı izah etmək və kəmiyyətini təyin etmək cəhdlərində işlənib hazırlanmışdır. Hərfi mənada teorem bizə tsiklik prosesin geri və ya geri dönməz olduğunu müəyyən etmək imkanı verir. Bu bərabərsizlik bizə ikinci qanunu başa düşmək üçün kəmiyyət düsturu təklif edir.
Alim entropiya ideyası üzərində ilk işləyənlərdən biri olub və hətta onu verib.prosesin adı. İndi Klauzius teoremi kimi tanınan şey ilk dəfə 1862-ci ildə Rudolfun altıncı əsərində, Daxili İşlər üçün Transformasiya Ekvivalent Teoreminin İstifadəsi haqqında nəşr olundu. Alim sistemdə qızdırmaqla (δ Q) entropiya ilə enerji axını arasında mütənasib əlaqəni göstərməyə çalışmışdır. Tikintidə bu istilik enerjisi işə çevrilə bilər və tsiklik bir proses vasitəsilə istiliyə çevrilə bilər. Rudolf sübut etdi ki, "tsiklik prosesdə baş verən bütün çevrilmələrin cəbri cəmi sıfırdan kiçik və ya ekstremal hallarda sıfıra bərabər ola bilər."
Qapalı təcrid sistem
İzolyasiya edilmiş sistem aşağıdakılardan biridir:
- Fiziki sistem onlarla qarşılıqlı əlaqədə olmayan digər sistemlərdən uzaqdır.
- Termodinamik sistem nə maddənin, nə də enerjinin keçə bilməyəcəyi sərt daşınmaz divarlarla bağlıdır.
Mövzunun daxili olaraq öz cazibə qüvvəsi ilə bağlı olmasına baxmayaraq, təcrid olunmuş sistem adətən xarici cazibə və digər uzaq qüvvələrin hüdudlarından kənara götürülür.
Bunu (termodinamikada istifadə edilən daha ümumi terminologiyada) enerjinin maddə deyil, istilik və ya iş şəklində ötürülə bilən seçici divarlarla əhatə olunmuş qapalı sistem adlandırılan sistemlə ziddiyyət təşkil etmək olar. Maddənin və enerjinin daxil olduğu və ya çıxdığı açıq bir sistemlə, baxmayaraq ki, içərisində müxtəlif keçilməz divarlar ola bilər.sərhədlərinin hissələri.
Təcrid olunmuş sistem qorunma qanununa tabedir. Çox vaxt termodinamikada maddə və enerji ayrı anlayışlar kimi qəbul edilir.
Termodinamik keçidlər
Kvant faza keçidlərini başa düşmək üçün onları klassik çevrilmələrlə (istilik inversiyaları da deyilir) müqayisə etmək faydalıdır. CPT sistemin termodinamik xassələrindəki zirvəni təsvir edir. Bu, hissəciklərin yenidən təşkil edilməsinə işarədir. Tipik bir nümunə, maye və bərk cisim arasında hamar bir keçidi təsvir edən suyun dondurucu keçididir. Klassik faza artımları sistemin enerjisi ilə onun istilik dalğalanmalarının entropiyası arasındakı rəqabətlə bağlıdır.
Klassik sistemin sıfır temperaturda entropiyası yoxdur və buna görə də faza çevrilməsi baş verə bilməz. Onların sırası birinci kəsikli törəmə termodinamik potensialla müəyyən edilir. Və təbii ki, onun birinci sifarişi var. Ferromaqnitdən paramaqnitə faza çevrilmələri davamlı və ikinci dərəcəlidir. Düzenli fazadan nizamsız fazaya qədər bu daimi dəyişikliklər sıfır olan sifariş parametri ilə təsvir olunur. Yuxarıdakı ferromaqnit çevrilmə üçün sifariş parametri sistemin ümumi maqnitləşməsi olacaq.
Gibbs potensialı
Gibbs Sərbəst Enerjisi, termodinamik qapalı sistemdən çıxarıla bilən (istilik mübadiləsi və ətraf mühitlə işləyə bilən) genişlənmədən maksimum iş həcmidir. Bu cürmaksimum nəticə yalnız tamamilə geri dönən prosesdə əldə edilə bilər. Sistem birinci vəziyyətdən ikinci vəziyyətə qayıtdıqda, Gibbs sərbəst enerjisindəki azalma, təzyiq qüvvələrinin işi çıxılmaqla sistemin öz mühitində etdiyinə bərabərdir.
Balans vəziyyəti

Termodinamik və mexaniki tarazlıq termodinamikanın aksiomatik anlayışıdır. Bu, daha çox və ya daha az keçirici və ya keçirməyən divarlarla birləşdirilmiş bir və ya bir neçə sistemin daxili vəziyyətidir. Bu vəziyyətdə nə sistem daxilində, nə də sistemlər arasında təmiz makroskopik maddə və ya enerji axını yoxdur.
Daxili tarazlıq vəziyyəti haqqında öz konsepsiyasında makroskopik dəyişiklik baş vermir. Sistemlər eyni vaxtda qarşılıqlı istilik, mexaniki, kimyəvi (sabit), radiasiya tarazlığında olurlar. Eyni formada ola bilərlər. Bu prosesdə fiziki əməliyyat pozulana qədər bütün görünüşlər bir anda və qeyri-müəyyən müddətə saxlanılır. Makroskopik tarazlıqda mükəmməl dəqiq balanslaşdırılmış mübadilələr baş verir. Yuxarıdakı sübut bu konsepsiyanın fiziki izahıdır.
Əsaslar
Hər qanunun, teoremlərin, düsturların öz əsasları var. Gəlin faza tarazlığı qanununun 3 əsasına baxaq.
- Faza kimyəvi tərkibə, fiziki vəziyyətə və mexaniki tarazlığa görə homojen olan maddə formasıdır. Tipik fazalar bərk, maye və qazdır. Ayrı bir sərhəd ilə ayrılmış iki qarışmayan maye (və ya müxtəlif tərkibli maye qarışıqları) iki fərqli faza və qarışmayan bərk cisimlər hesab olunur.
- Kompentlərin sayı (C) sistemin kimyəvi cəhətdən müstəqil komponentlərinin sayıdır. Sistemin bütün fazalarının tərkibini müəyyən etmək üçün tələb olunan minimum müstəqil növlərin sayı.
- Bu kontekstdə sərbəstlik dərəcələrinin sayı (F) bir-birindən asılı olmayan intensiv dəyişənlərin sayıdır.
Faza tarazlığına görə təsnifat
- Davamlı xalis köçürmə reaksiyaları (çox vaxt bərk hal reaksiyaları adlanır) müxtəlif tərkibli bərk maddələr arasında baş verir. Onlar mayelərdə olan elementləri (H, C) ehtiva edə bilər, lakin bu elementlər bərk fazalarda saxlanılır, buna görə də heç bir maye faza reaktivlər və ya məhsullar kimi iştirak etmir (H2O, CO2). Bərk saf transfer reaksiyaları davamlı və ya fasiləli və ya terminal ola bilər.
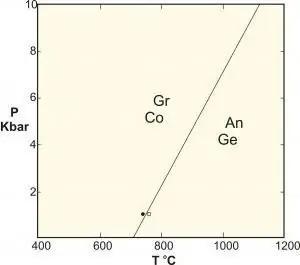
- Polimorf eyni tərkibli fazaları özündə birləşdirən bərk faza reaksiyasının xüsusi növüdür. Klassik nümunələr alüminium silikatları siyanit-sillimanit-andalusit arasındakı reaksiyalar, yüksək təzyiqdə qrafitin almaza çevrilməsi və kalsium karbonatın tarazlığıdır.
Tarazlıq qanunları

Gibbs Fabriki Qaydası Josiah Willard Gibbs tərəfindən 1875-1878-ci illərdə çıxan "Heterojen maddələrin tarazlığı" adlı məşhur məqaləsində təklif edilmişdir. -a aiddirtermodinamik tarazlıqda reaktiv olmayan çoxkomponentli heterojen sistemlər verilmiş bərabərlikdir:
- F=C-P+2;
- burada F sərbəstlik dərəcələrinin sayıdır;
- C - komponentlərin sayı;
- P - bir-biri ilə termodinamik tarazlıqda olan fazaların sayı.
Sərbəstlik dərəcələrinin sayı boş intensiv dəyişənlərin sayıdır. Temperatur və ya təzyiq kimi bir-birinə təsir etmədən eyni vaxtda və özbaşına dəyişə bilən ən çox termodinamik parametrlər. Su və etanol qarışıqları kimi iki komponentli sistemlər iki müstəqil komponentə malik olduğu halda, birkomponentli sistemə misal olaraq, tək təmiz kimyəvi tərkibli sistem göstərilə bilər. Tipik faza keçidləri (faza tarazlığı) bərk cisimlər, mayelər və qazlardır.
Daimi təzyiqdə faza qaydası
Müxtəlif bərk strukturlar arasında faza dəyişiklikləri ilə məşğul olan materialşünaslıqda tətbiqlər üçün sabit təzyiq tez-tez baş verir (məsələn, bir atmosfer) və sərbəstlik dərəcəsi kimi nəzərə alınmır, beləliklə qayda belə olur: F=C - P + 1.
Bu düstur bəzən "kondensasiya olunmuş faza qaydası" adı altında təqdim edilir, lakin bildiyimiz kimi, yüksək təzyiqlərə məruz qalan bu sistemlərə (məsələn, geologiyada) tətbiq edilmir, çünki bunların nəticələri təzyiqlər fəlakətli nəticələrə səbəb ola bilər.
Elə görünə bilər ki, faza tarazlığı sadəcə boş bir ifadədir və bu anın keçdiyi bir neçə fiziki proses var.iştirak edir, lakin gördüyümüz kimi, onsuz bildiyimiz bir çox qanunlar işləmir, ona görə də bu unikal, rəngarəng, bir az da darıxdırıcı qaydalarla bir az tanış olmaq lazımdır. Bu bilik bir çox insana kömək etdi. Onları özlərinə tətbiq etməyi öyrəndilər, məsələn, elektrikçilər fazalarla işləmə qaydalarını bilərək, özlərini lazımsız təhlükədən qoruya bilərlər.






