Hər bir insan həyatı boyu maddənin üç məcmu vəziyyətindən birində olan bədənlərlə qarşılaşır. Öyrənmək üçün ən sadə birləşmə vəziyyəti qazdır. Məqalədə biz ideal qaz anlayışını nəzərdən keçirəcəyik, sistemin vəziyyət tənliyini verəcəyik, həmçinin mütləq temperaturun təsvirinə bir qədər diqqət yetirəcəyik.
Maddənin qaz vəziyyəti
Hər bir tələbə "qaz" sözünü eşidəndə maddənin hansı vəziyyətindən danışdığını yaxşı bilir. Bu söz ona verilən istənilən həcmi tutmağa qadir olan bədən kimi başa düşülür. O, öz formasını saxlaya bilmir, çünki ən kiçik xarici təsirlərə belə müqavimət göstərə bilmir. Həmçinin, qaz həcmi saxlamır, bu onu təkcə bərk cisimlərdən deyil, həm də mayelərdən fərqləndirir.
Maye kimi qaz da maye maddədir. Qazlarda bərk cisimlərin hərəkəti prosesində sonuncular bu hərəkətə mane olur. Yaranan qüvvə müqavimət adlanır. Onun dəyəri asılıdırbədənin qazdakı sürəti.
Qazların güclü nümunələri hava, evləri qızdırmaq və yemək bişirmək üçün istifadə edilən təbii qaz, reklam parıltı borularını doldurmaq üçün istifadə edilən və ya qaynaq zamanı inert (aqressiv olmayan, qoruyucu) mühit yaratmaq üçün istifadə olunan inert qazlar (Ne, Ar) ola bilər..
İdeal qaz
Qaz qanunlarının təsvirinə və vəziyyət tənliyinə keçməzdən əvvəl siz ideal qazın nə olduğu sualını yaxşı başa düşməlisiniz. Bu konsepsiya molekulyar kinetik nəzəriyyədə (MKT) təqdim edilmişdir. İdeal qaz aşağıdakı xüsusiyyətlərə cavab verən istənilən qazdır:
- Onu əmələ gətirən hissəciklər birbaşa mexaniki toqquşmalar istisna olmaqla bir-biri ilə qarşılıqlı təsir göstərmir.
- Zərrəciklərin qabın divarları ilə və ya öz aralarında toqquşması nəticəsində onların kinetik enerjisi və impulsu saxlanılır, yəni toqquşma mütləq elastik sayılır.
- Zərrəciklərin ölçüləri yoxdur, lakin məhdud kütləyə malikdirlər, yəni maddi nöqtələrə bənzəyirlər.
İstənilən qazın ideal deyil, real olması təbiidir. Buna baxmayaraq, bir çox praktiki problemlərin həlli üçün bu yaxınlaşmalar kifayət qədər etibarlıdır və istifadə edilə bilər. Ümumi empirik bir qayda var ki, belə deyir: kimyəvi təbiətindən asılı olmayaraq, əgər qazın temperaturu otaq temperaturundan yuxarı və atmosfer səviyyəsindən və ya daha aşağı təzyiqə malikdirsə, o zaman yüksək dəqiqliklə ideal hesab edilə bilər və onu təsvir etmək üçün istifadə edilə bilər. o.ideal qaz vəziyyət tənliyinin düsturu.
Klapeyron-Mendeleyev qanunu
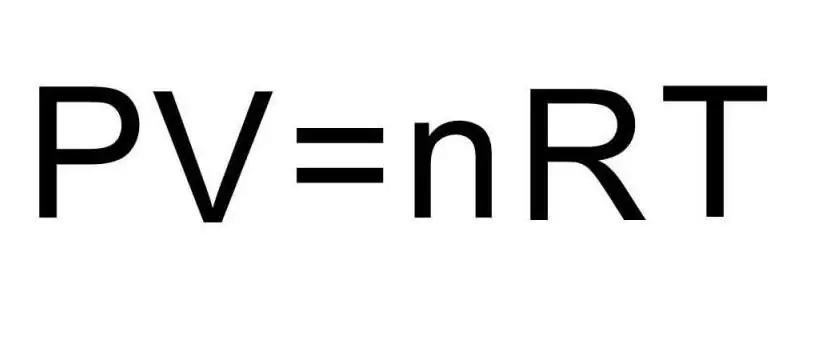
Materiyanın müxtəlif aqreqat halları və tək məcmu dövlət daxilindəki proseslər arasında keçidlər termodinamika tərəfindən idarə olunur. Təzyiq, temperatur və həcm termodinamik sistemin istənilən vəziyyətini unikal şəkildə müəyyən edən üç kəmiyyətdir. İdeal qazın vəziyyət tənliyi düsturu bu üç kəmiyyətin hamısını vahid bərabərliyə birləşdirir. Bu düsturu yazaq:
PV=nRT
Burada P, V, T - müvafiq olaraq təzyiq, həcm, temperatur. n-nin dəyəri maddənin moldakı miqdarıdır və R simvolu qazların universal sabitini bildirir. Bu bərabərlik onu göstərir ki, təzyiq və həcmin hasili nə qədər böyükdürsə, maddənin miqdarı ilə temperaturun hasili də bir o qədər çox olmalıdır.

Qazın hal tənliyinin düsturuna Klapeyron-Mendeleyev qanunu deyilir. 1834-cü ildə fransız alimi Emil Klapeyron öz sələflərinin eksperimental nəticələrini ümumiləşdirərək bu tənliyə gəldi. Bununla belə, Klapeyron bir sıra sabitlərdən istifadə etdi, sonralar onları Mendeleyev biri ilə əvəz etdi - universal qaz sabiti R (8, 314 J / (molK)). Ona görə də müasir fizikada bu tənlik fransız və rus alimlərinin adları ilə adlandırılır.

Digər Tənlik Formaları
Yuxarıda biz ümumi qəbul edilmiş və ideal qaz üçün Mendeleyev-Klapeyron vəziyyət tənliyini yazdıq.rahat forma. Bununla belə, termodinamika problemlərində çox vaxt bir qədər fərqli forma tələb oluna bilər. Aşağıda yazılı tənlikdən birbaşa gələn daha üç düstur yazılmışdır:
PV=NkBT;
PV=m/MRT;
P=ρRT/M.
Bu üç tənlik ideal qaz üçün də universaldır, yalnız onlarda kütlə m, molyar kütlə M, sıxlıq ρ və sistemi təşkil edən hissəciklərin sayı N kimi kəmiyyətlər görünür. Burada kB simvolu Boltzman sabitini bildirir (1, 3810-23J/K).
Boyle-Mariotte Qanunu
Klapeyron tənliyini tərtib edərkən, bir neçə onilliklər əvvəl eksperimental olaraq kəşf edilmiş qaz qanunlarına əsaslanırdı. Onlardan biri Boyle-Mariotte qanunudur. Qapalı sistemdə izotermik prosesi əks etdirir, bunun nəticəsində təzyiq və həcm kimi makroskopik parametrlər dəyişir. İdeal qazın vəziyyət tənliyinə T və n sabitini qoysaq, qaz qanunu aşağıdakı formanı alacaq:
P1V1=P2V 2
Bu, ixtiyari izotermik proses zamanı təzyiq və həcm məhsulunun saxlanıldığını söyləyən Boyle-Mariotte qanunudur. Bu halda P və V dəyərləri özləri dəyişir.
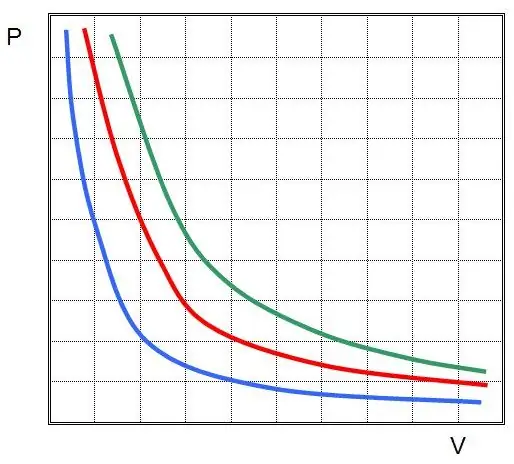
Əgər P(V) və ya V(P) qrafikini çəksəniz, izotermlər hiperbolalar olacaq.
Çarlz və Gay-Lussac qanunları
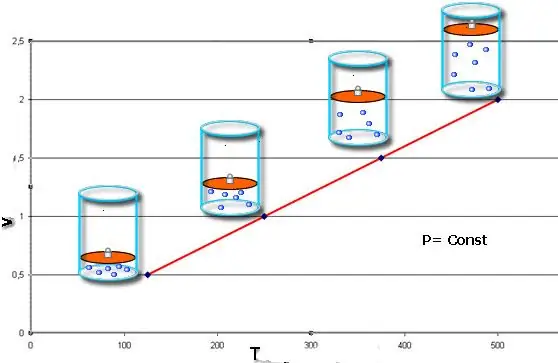
Bu qanunlar riyazi olaraq izobar və izoxoriyanı təsvir edirproseslər, yəni müvafiq olaraq təzyiq və həcmin saxlanıldığı qaz sisteminin vəziyyətləri arasında belə keçidlər. Çarlz qanunu riyazi olaraq belə yazıla bilər:
V/T=n olduqda sabit, P=sabit.
Gay-Lussac qanunu belə yazılır:
P/T=n olduqda sabit, V=sabit.
Əgər hər iki bərabərlik qrafik şəklində təqdim edilərsə, onda x oxuna müəyyən bucaq altında maili olan düz xətlər alacağıq. Bu tip qrafik sabit təzyiqdə həcm və temperatur, sabit həcmdə isə təzyiq və temperatur arasında birbaşa mütənasibliyi göstərir.
Qeyd edək ki, nəzərdən keçirilən hər üç qaz qanunu qazın kimyəvi tərkibini, eləcə də maddənin miqdarının dəyişməsini nəzərə almır.
Mütləq temperatur
Gündəlik həyatda ətrafımızdakı prosesləri təsvir etmək üçün əlverişli olduğundan Selsi temperatur şkalasından istifadə etməyə öyrəşmişik. Beləliklə, su 100 oC-də qaynayır və 0 oC-də donur. Fizikada bu miqyas əlverişsizdir, buna görə də 19-cu əsrin ortalarında Lord Kelvin tərəfindən təqdim edilən mütləq temperatur şkalası istifadə olunur. Bu şkala uyğun olaraq, temperatur Kelvin (K) ilə ölçülür.
Hesab olunur ki, -273, 15 oC temperaturda atomların və molekulların istilik vibrasiyası olmur, onların irəliyə doğru hərəkəti tamamilə dayanır. Selsi dərəcəsində olan bu temperatur Kelvində (0 K) mütləq sıfıra uyğundur. Bu tərifdənmütləq temperaturun fiziki mənası belədir: maddəni təşkil edən hissəciklərin, məsələn, atomların və ya molekulların kinetik enerjisinin ölçüsüdür.
Mütləq temperaturun yuxarıdakı fiziki mənası ilə yanaşı, bu kəmiyyəti anlamaq üçün başqa yanaşmalar da var. Onlardan biri Çarlzın qeyd olunan qaz qanunudur. Gəlin bunu aşağıdakı formada yazaq:
V1/T1=V2/T 2=>
V1/V2=T1/T 2.
Sonuncu bərabərlik deyir ki, sistemdəki maddənin müəyyən miqdarında (məsələn, 1 mol) və müəyyən təzyiqdə (məsələn, 1 Pa) qazın həcmi mütləq temperaturu unikal şəkildə müəyyən edir. Başqa sözlə, bu şərtlərdə qazın həcminin artması yalnız temperaturun artması hesabına mümkündür və həcmin azalması T.
dəyərinin azalmasından xəbər verir.
Xatırladaq ki, Selsi temperaturundan fərqli olaraq mütləq temperatur mənfi ola bilməz.
Avogadro prinsipi və qaz qarışıqları
Yuxarıda göstərilən qaz qanunlarına əlavə olaraq, ideal qaz üçün vəziyyət tənliyi həm də Amedeo Avoqadronun 19-cu əsrin əvvəllərində kəşf etdiyi və onun soyadını daşıyan prinsipə gətirib çıxarır. Bu prinsip sabit təzyiq və temperaturda istənilən qazın həcminin sistemdəki maddənin miqdarı ilə müəyyən edildiyini müəyyən edir. Müvafiq düstur belə görünür:
n/V=sabit olduqda P, T=sabit.
Yazılı ifadə ideal qaz fizikasında yaxşı tanınan qaz qarışıqları üçün D alton qanununa gətirib çıxarır. Buqanunda deyilir ki, qarışıqdakı qazın qismən təzyiqi onun atom hissəsi ilə unikal şəkildə müəyyən edilir.
Problemin həlli nümunəsi
Tərkibində ideal qaz olan sərt divarlı qapalı qabda qızdırma nəticəsində təzyiq 3 dəfə artmışdır. İlkin dəyəri 25 oC olduqda sistemin son temperaturunu müəyyən etmək lazımdır.
İlk olaraq temperaturu Selsi dərəcəsindən Kelvinə çevirək, bizdə:
T=25 + 273, 15=298, 15 K.
Gəminin divarları sərt olduğu üçün isitmə prosesini izoxorik hesab etmək olar. Bu halda, biz Gey-Lussac qanununu tətbiq edirik, bizdə:
P1/T1=P2/T 2=>
T2=P2/P1T 1.
Beləliklə, son temperatur təzyiq nisbəti ilə ilkin temperaturun hasilindən müəyyən edilir. Verilənləri bərabərliklə əvəz etməklə biz cavabı alırıq: T2=894.45 K. Bu temperatur 621.3 oC-yə uyğundur.






