Fizikada tərifləri bilmək müxtəlif fiziki problemləri uğurla həll etmək üçün əsas amildir. Məqalədə biz ideal qaz sistemi üçün izobar, izoxorik, izotermik və adiabatik proseslərin nə demək olduğunu nəzərdən keçirəcəyik.
İdeal qaz və onun tənliyi
İzobar, izoxorik və izotermik proseslərin təsvirinə keçməzdən əvvəl ideal qazın nə olduğunu nəzərdən keçirək. Fizikada bu tərifə əsasən, bütün istiqamətlərdə yüksək sürətlə hərəkət edən çoxlu sayda ölçüsüz və qarşılıqlı təsir göstərməyən hissəciklərdən ibarət bir sistem hesab edirlər. Əslində, söhbət atomlar və molekullar arasındakı məsafələrin öz ölçülərini xeyli aşdığı və kinetik enerji ilə müqayisədə kiçikliyinə görə hissəciklərin qarşılıqlı təsirinin potensial enerjisinə əhəmiyyət verilmədiyi maddənin qaz aqreqat vəziyyətindən gedir.
İdeal qazın vəziyyəti onun termodinamik parametrlərinin cəmidir. Əsas olanlar temperatur, həcm və təzyiqdir. Onları müvafiq olaraq T, V və P hərfləri ilə işarə edək. XIX əsrin 30-cu illərindəKlapeyron (fransız alimi) əvvəlcə göstərilən termodinamik parametrləri vahid bərabərlik daxilində birləşdirən tənliyi yazdı. Belə görünür:
PV=nRT,
burada n və R müvafiq olaraq maddələrin miqdarı və qaz sabitidir.
Qazlarda izoproseslər hansılardır?
Çoxlarının qeyd etdiyi kimi, izobarik, izoxorik və izotermik proseslər öz adlarında eyni "iso" prefiksini istifadə edir. Bu, bütün prosesin keçməsi zamanı bir termodinamik parametrin bərabərliyi deməkdir, qalan parametrlər isə dəyişir. Məsələn, izotermik proses onu göstərir ki, nəticədə sistemin mütləq temperaturu sabit saxlanılır, izoxorik proses isə sabit həcmi göstərir.
İzoprosesləri öyrənmək üçün əlverişlidir, çünki termodinamik parametrlərdən birinin təyin edilməsi qaz vəziyyətinin ümumi tənliyinin sadələşdirilməsinə gətirib çıxarır. Bütün bu izoproseslər üçün qaz qanunlarının eksperimental olaraq kəşf edildiyini qeyd etmək vacibdir. Onların təhlili Klapeyrona azaldılmış universal tənliyi əldə etməyə imkan verdi.
İzobarik, izoxorik və izotermik proseslər
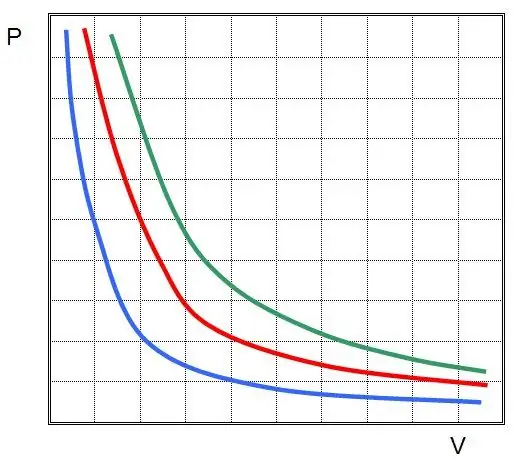
İdeal qazda izotermik proses üçün ilk qanun kəşf edilmişdir. İndi bu, Boyle-Mariotte qanunu adlanır. T dəyişmədiyi üçün vəziyyət tənliyi bərabərliyi nəzərdə tutur:
PV=sabit.
Başqa sözlə, qazın temperaturu sabit saxlanılarsa sistemdə təzyiqin hər hansı dəyişməsi onun həcmində tərs mütənasib dəyişikliyə səbəb olur. P(V) funksiyasının qrafikihiperbola.
İzobar proses - bu, təzyiqin sabit qaldığı sistemin vəziyyətində dəyişiklikdir. Klapeyron tənliyində P dəyərini təyin etdikdən sonra aşağıdakı qanunu əldə edirik:
V/T=sabit.
Bu bərabərlik 18-ci əsrin sonunda onu almış fransız fiziki Jak Şarlzın adını daşıyır. İzobar (V(T) funksiyasının qrafik təsviri) düz xətt kimi görünür. Sistemdə təzyiq nə qədər çox olarsa, bu xətt bir o qədər tez yüksəlir.
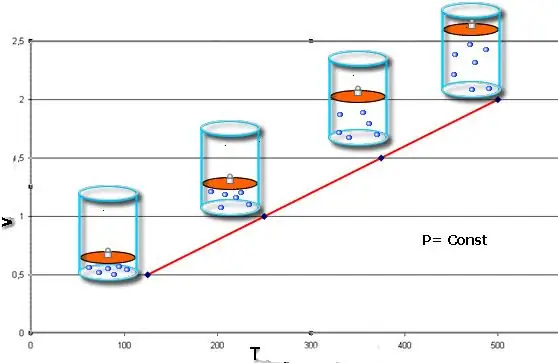
Qaz pistonun altında qızdırılırsa, izobar prosesi asan həyata keçirilir. Sonuncunun molekulları sürətini (kinetik enerjisini) artırır, pistonda daha yüksək təzyiq yaradır, bu da qazın genişlənməsinə və sabit dəyərinin saxlanılmasına səbəb olur P.
Nəhayət, üçüncü izoproses izoxorikdir. Sabit bir həcmlə işləyir. Vəziyyət tənliyindən müvafiq bərabərliyi əldə edirik:
P/T=sabit.
Fiziklər arasında Gey-Lussac qanunu kimi tanınır. Təzyiq və mütləq temperatur arasındakı birbaşa mütənasiblik onu göstərir ki, izoxorik prosesin qrafiki, izobarik prosesin qrafiki kimi, müsbət yamaclı düz xəttdir.
Bütün izoproseslərin qapalı sistemlərdə baş verdiyini başa düşmək vacibdir, yəni onların gedişi zamanı n-in dəyəri saxlanılır.
Adiabatik proses
Bu proses "iso" kateqoriyasına aid deyil, çünki onun keçidi zamanı hər üç termodinamik parametr dəyişir. adiabatikətraf mühitlə istilik mübadiləsi aparmayan sistemin iki vəziyyəti arasında keçid adlanır. Beləliklə, sistemin genişlənməsi onun daxili enerji ehtiyatları hesabına həyata keçirilir ki, bu da onun içindəki təzyiqin və mütləq temperaturun əhəmiyyətli dərəcədə azalmasına səbəb olur.
İdeal qaz üçün adiabatik proses Puasson tənlikləri ilə təsvir edilmişdir. Onlardan biri aşağıda göstərilir:
PVγ=const,
burada γ sabit təzyiqdə və sabit həcmdə istilik tutumlarının nisbətidir.
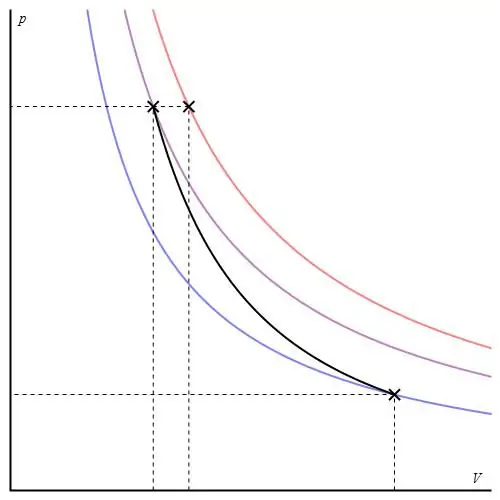
Adiabatik qrafik izoxorik proses qrafikindən və izobar qrafikdən fərqlənir, lakin o, hiperbolaya (izotermaya) bənzəyir. P-V oxlarındakı adiabat izotermadan daha kəskin davranır.






